Neue Therapie-option identifiziert, die für die Frühphasen-Brustkrebs
Radionuklid-Therapie als erfolgreich erwiesen hat, verzögern das Wachstum von disseminierten Tumorzellen (DTCs) in early-stage breast cancer in a small animal model, was auf seine Verwendung als eine potenzielle adjuvante Therapie zur Verlangsamung der proliferation von DTCs. Wie berichtet in der Januar-Ausgabe des Journal of Nuclear Medicine, das alpha-particle-emitting-rp 223RaCl2 nicht nur Auswirkungen auf Zellen direkt Treffer durch Strahlung, sondern hat auch erhebliche Auswirkungen auf die Zellen, die sich außerhalb des strahlungsfeldes (d.h., bystander-Zellen).
Brustkrebs ist der häufigste Krebs diagnostiziert, bei Frauen in den Vereinigten Staaten. Während die überlebensraten für Frauen hoch sind, etwa 20 Prozent fünf-Jahres-überlebenden letztlich entwickeln metastasierende Erkrankung fünf bis zehn Jahren nach der Behandlung. Die Bildung von Metastasen beinhaltet zirkulierenden tumor-Zellen, die Schuppen, die vom primären tumor und erhalten Sie Zugriff auf das Herz-Kreislauf-system. Diese DTCs erleiden können aktive Verbreitung und entwickeln sich zu macrometastases oder bleiben schlafend für Jahre, bevor Sie aktiv werden.
„Mit einem erneuerten Interesse an der Therapie mit alpha-Teilchen-Strahlern und deren Potenzial für die Sterilisierung der DTCs unserer Studie suchte, zu bestimmen, ob bystander-Effekte eine Rolle spielen, 223RaCl2 Therapie und, wenn ja, ob Sie genutzt werden kann, zur Behandlung von Dtc vor dem Fortschreiten der Erkrankung“, bemerkte Roger W. Howell, Ph. D., und co-Autoren an der Rutgers New Jersey Medical School, der University of Florida und Universität von Göteborg.
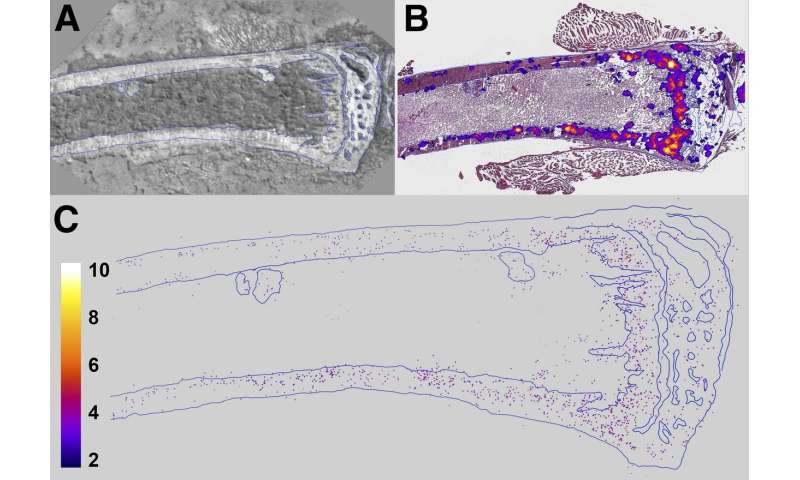
In der Studie, weiblichen Mäusen verabreicht wurden 0, 50 oder 600 kBq/kg 223RaCl2 zu erstellen bystander Bedingungen vor tumorzell-Impfung. Nach 24 Stunden wurden Mäuse geimpft-entweder mit östrogen-rezeptor-positiven menschlichen Brustkrebszellen oder triple-negativ (östrogen-rezeptor-negativ und Progesteron-rezeptor-negativen und humanen epidermalen Wachstumsfaktor-rezeptor-2-negativen) menschlichen Brustkrebs-Zellen in den tibialen Knochenmark-Fach. Der Biolumineszenz-Intensität der geimpften tumor-Zell-Populationen gemessen wurde an Tag eins und wöchentlich danach.
Tumor-Last-Analyse ergab, dass DTCs vorhanden waren, sowohl innerhalb als auch außerhalb der Reichweite der alpha-Teilchen emittiert von 223RaCl2 in beiden Arten von Brustkrebs-Zellen. Wachstumsverzögerungen wurden dann verfolgt, für jede Gruppe von Brustkrebs-Zellen. Östrogen-rezeptor-positiven Brustkrebs-Zellen reagierten auf die 50 und 600 kBq/kg-Behandlungen mit sieben-Tage-und 65-Tage-Wachstums-Verzögerungen, beziehungsweise. Im Gegensatz dazu wird das triple-negative Brustkrebs-Zellen zeigten eine 10-Tages-Wachstums-Verzögerung in der tumor-progression für die 600 kBq/kg-Gruppe. Kein signifikanter Unterschied wurde festgestellt für das triple-negative breast cancer cell Gruppe verwaltet 50 kBq/kg, wenn im Vergleich zu der Kontrollgruppe.
„Das gestiegene Ausmaß der bystander-Effekt in dieser Studie legt nahe, dass höhere injiziert Aktivitäten können besser sterilisieren unentdeckt ruhende oder langsam wachsende DTCs im Knochenmark Mikro-Umwelt.,“ sagte Howell und co-Autoren. „So, 223RaCl2 möglicherweise eine adjuvante Therapieoption für ausgewählte Patienten mit frühen Stadien von Brustkrebs.
Sie fuhr Fort, „Diese Studie ergänzt die Montage-Nachweise, dass die Strahlung-induzierte bystander-Effekte können eine Rolle spielen in der Gestaltung der zukünftigen Planungen für Radiopharmaka allein oder in Kombination mit externen Strahl Therapie. Zudem sind die Kapazitäten, um spezifische Zellen oder Gewebe in einer systemischen Art und Weise bieten möglicherweise Vorteile gegenüber der Verwendung von externe Strahlen der Strahlung, die für die Eruierung therapeutische Zuschauer Antworten.“
Die Autoren von „Dosis-Abhängigen Wachstums-Verzögerung von Brustkrebs Xenografts im Knochenmark von Mäusen Behandelt mit 223Ra: Die Rolle der „Bystander-Effekte und Deren Potenzial für die Therapie“ gehören Calvin N. Leung, Edouard I. Azzam und Roger W. Howell, Department of Radiology, New Jersey Medical School der Rutgers University, Newark, New Jersey; Brian S. Canter, Department of Radiology, New Jersey Medical School der Rutgers University, Newark, New Jersey, und die Abteilung der Orthopädie, der New Jersey Medical School der Rutgers University, Newark, New Jersey; J. Christopher Fritton, Abteilung für Orthopädie, New Jersey Medical School der Rutgers University, Newark, New Jersey; Didier Rajon, Department of Neurosurgery, University of Florida, Gainesville, Florida; und Tom A. Bäck, Department of Radiation Physics, Sahlgrenska-Akademie, Universität Göteborg, Göteborg, Schweden.
