Engineering Forschung vertieft das Verständnis der glucose-insulin-Interaktion

Wenn insulin ausgeschüttet wird von beta-Zellen in der Bauchspeicheldrüse an, die Kontrolle des Blutzuckerspiegels im Blut, GABA ist auch freigegeben von den Zellen, um Sie zu beruhigen, so dass die Zellen sich vorbereiten für den nächsten Puls der insulin-Sekretion. Mit einer stabilen Insulinspiegel ist der Schlüssel für das funktionieren einer gesunden Bauchspeicheldrüse. Beeinträchtigung der beta-Zellen GABA-Biosynthese oder die Freisetzung von GABA aus der Zelle verlassen konnte Inselchen Gewebe anfällig für Dysfunktionen oder Entzündungen im Zusammenhang mit Typ-1-und Typ-2-diabetes.
Edward Phelps, Ph. D., assistant professor in der J. Crayton Pruitt Familie Department of Biomedical Engineering an der UF, Walker Hagan, Ph. D.-student in der Phelps-Labor, und ein interdisziplinäres team haben eine Methode entwickelt, um zu Messen, wo und wie gamma-amino-Buttersäure (GABA) ist veröffentlicht von beta-Zellen in der Bauchspeicheldrüse. Dr. Phelps und seinen Kollegen veröffentlichte ein Papier über Ihre Ergebnisse in der Natur Stoffwechsel, 2019 Nov 15, 11(1).
GABA wird in den beta-Zellen der Bauchspeicheldrüse an fast der gleichen Konzentration wie in den Nervenzellen des Gehirns. Für den letzten 30 Jahren dachten Wissenschaftler, dass GABA freigesetzt wurde aus den beta-Zellen in der gleichen Weise wie in den Nervenzellen. Im Gehirn ist GABA gespeichert in kleine Lungenbläschen (Vesikeln) am Ende der Nervenzelle. Wenn ein Nervenimpuls regt die Vesikel im axon der Zelle zu übertragen den Impuls auf die nächste Nervenzelle ist GABA auch abgesondert von den Bläschen. GABA wirkt, den Nerv zu beruhigen, so dass es ist bereit für den nächsten Impuls. Doch die Wissenschaftler waren nicht in der Lage zu suchen, eine vesikuläre GABA-transporter in 99% der beta-Zellen, wodurch die traditionelle Erklärung für die GABA-Freisetzung aus den beta-Zellen in der Bauchspeicheldrüse.
Während seiner frühen Forschung in diesem Bereich, Dr. Phelps beobachtet, dass GABA nicht verpackt in Vesikel innerhalb von beta-Zellen des Pankreas; vielmehr ist es gleichmäßig verteilt, während der beta-Zelle. Befund, dass GABA wurde nicht abgesondert von Vesikeln in der beta-Zelle, Dr. Phelps und seine Kollegen versuchten einen anderen Weg für die Freisetzung von GABA aus der beta-Zelle.
„Es gibt einen Kanal zwischen dem inneren der beta-Zellen und der extrazelluläre Raum, das wir dachten, war eine Untersuchung Wert,“ sagte Phelps. „Das Volumen regulatory anion channel (VRAC) ist bekannt für einen anderen Zweck. Es wird verwendet, um die Zellen helfen, Ihre Form beizubehalten, halten den osmotischen Druck innerhalb und außerhalb der Zelle im Gleichgewicht. Wenn dieses Gleichgewicht gestört ist und die Zellform ändert, werden kleine organische Chemikalien bekannt als osmolyte werden vertrieben von der Zelle über die VRAC-Kanal an die der Zelle helfen, wieder seine Form. Wenn wir künstlich geöffnet dieser Kanal wird in beta-Zellen mit low-saline, fanden wir, dass dieser Kanal auch Transporte GABA.“
Die Forscher verwendeten eine Kombination aus high performance liquid Chromatographie (HPLC) und GABA-biosensor-Zelle-assays zur Messung der Dynamik von GABA-Freisetzung aus menschlichen Inseln. In einer Reihe von Experimenten mit hypotonischen Kochsalzlösung zum öffnen des VRAC-Kanals, einem biosensor gestellt wurde stromabwärts von Pankreas-Inseln mit beta Zellen. Der biosensor fluoreszierten, wenn GABA veröffentlicht wurde und angezeigt wurde mittels konfokaler Mikroskopie.
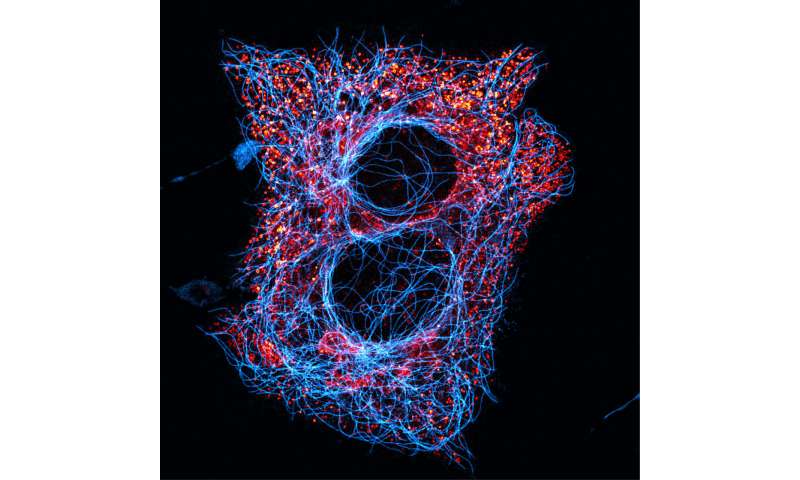
Aus Ihrer Forschung, Dr. Phelps und seine Kollegen konnten zeigen, dass in humanen Pankreas-Inselzellen (beta-Zellen):
(1) GABA freigesetzt wird unabhängig von der Glukose-Konzentration und in Impulse, die auftreten, mit einer Frequenz im gleichen Bereich wie die von pulsatile in-vivo-insulin-Sekretion;
(2) GABA ist ein diffusionsfähig Faktor handeln auf die GABA-Rezeptoren, deren Aktivierung reguliert beta-Zell-Aktivität (autokrine Signalisierung); und
(3) die GABA-Produktion und-Freisetzung regulieren können die Intervalle der insulin-Sekretion.
Diese Ergebnisse stellen eine bisher unbeschriebene Modus autokrine Signalisierung in der Insel, möglicherweise erstrecken sich auch auf vielen anderen Zelltypen und Geweben bekannt ist, zu verwenden GABA-Signalisierung. „Wie andere Forscher aufbauen auf dem, was wir getan haben, und zeigen reproduzierbare Ergebnisse erhalten, werden wir eröffnen völlig neue Bereiche der biomedizinischen Forschung können Wissenschaftler untersuchen-auch möglich, neue Behandlungen für diabetes und mögliche Verteidigung gegen autoimmune Aktivität,“ Phelps abgeschlossen.
„Die Veröffentlichung dieser Ergebnisse in einer der renommiertesten Zeitschriften im Bereich, Natur-Stoffwechsel, ist schon eine große Leistung, die zeigt, wie wichtig und peer Respekt für die Forschung, geführt von Dr. Phelps und seinen Kollegen. Durch interdisziplinäre Kooperationen wie diese, die Fakultät in der Universität von Florida Biomedical Engineering an die Grenzen der wissenschaftlichen und technologischen Fortschritt untermauert der medizinischen Innovationen, die uns alle beeinflussen,“ kommentiert Christine Schmidt, Ph. D., professor, J. Crayton Pruitt Familie Lehrstuhl und Professur für Biomedical Engineering.
