Boston Partnerschaft nutzt lokale Fertigung, um schnell die Erstellung von wiederverwendbaren Gesicht Schilde

Forscher bei einem großen Boston academic medical center entwickelt, gefertigt, getestet und implementiert eine wiederverwendbare Gesichtsschutz für front-line medizinisches Personal innerhalb von ein paar Wochen. Die Arbeit, präsentiert 18. Juni in der Zeitschrift Med, erfolgte am Brigham and Women ‚ s Hospital Emergency Department in Zusammenarbeit mit den Mitgliedern der Freiwilligen-Gruppe Greater Boston Pandemie Herstellung Team (PanFab) und die lokale maker-community.
Die Autoren der Studie sagen, es bietet einen effizienten und allgemein anwendbaren Ansatz für die Nutzung der lokalen Fertigungs-Prozesse schnell zu produzieren persönliche Schutzausrüstung (PSA) während die öffentliche Gesundheit Notfälle. Das Papier enthält alle Anweisungen und Modell-Dateien zu erzeugen, die Gesicht-Schilde.
„Alle Entwürfe und Protokolle, die durch diese Anstrengung werden frei ausgetauscht für die Wiederverwendung und die Verbesserung, und die Ergebnisse unserer Tests in der Notfall-Abteilung am Brigham berichtet, die in voller Erleichterung der Ausführung von ähnlichen face-shield Bemühungen in anderen klinischen Einstellungen,“ sagt co-senior-Autor der Studie, Sherry Yu von der Brigham und der Harvard Medical School. „Wir erwarten, dass diese arbeiten bieten einen Rahmen für die Gestaltung und Umsetzung von ähnlichen Konzepten auf den PSA-Fertigung für die aktuellen und zukünftigen Engpässen.“
Angesichts einer schnell wachsenden coronavirus Krankheit 2019 (COVID-19) – Pandemie, schwere PSA, die Mangel haben legen sowohl die Angehörigen der Gesundheitsberufe und Patienten, die ein erhöhtes Risiko der Infektion. Die Ursprünge dieser Mangel spiegeln die Fragilität der medizinischen Versorgung Ketten, in denen relativ wenige internationale Anbieter Dominieren kritische medizinische Produkt-Bereichen. Weil viele Krankenhäuser verwenden just-in-time-Inventar-management, supply-chain-Probleme schnell erschöpft Krankenhaus versorgt und verhindern, dass Nachschub aus der traditionellen Anbieter. Zwei Monate in der COVID-19-Pandemie in den USA, traditionelle Lieferketten Massiv gestört, und die viel beworbenen alternativen Quellen der Versorgung von großen Unternehmen noch nicht weit verbreitet.
Konfrontiert mit dieser Krise, viele Pfleger und medizinische Zentren haben, wandte sich an lokale Verarbeiter, die Verwendung von 3-D-Druck zu bieten Ersatz für Produkte wie Gesichtsschutz, Atemschutzmasken filtern, und sogar ventilator Komponenten. Vor kurzem, viele public-domain-designs für Gesicht Schilde zur Verfügung. Gruppen nutzen diese Entwürfe gefunden haben, dass die Einführung von Gesicht Schilde und ähnliche PSA in eine Gesundheitsversorgung Einstellung ist anspruchsvoll. Trotz Ihrer relativ einfachen design, Gesicht Schilde sind geregelt in den USA durch die Centers for Disease Control und der Food and Drug Administration (FDA). Im April, die FDA erteilt einen Brief besagt, dass es „nicht die Absicht zu widersprechen, die Individuen Verteilung und Verwendung von improvisierten PSA, wenn keine alternativen, wie FDA-gelöscht-Masken oder Atemschutzmasken, zur Verfügung stehen.“
Noch kein klarer Pfad vorhanden ist, für die Einführung einer lokal gefertigten Produkt in einer klinischen Einstellung. „Die FDA-Brief bietet einen rechtlichen Rahmen, in dem die Verwendung lokal hergestellt, improvisierte PSA in den USA, aber es geht nicht auf die mehr Allgemeine Frage der Einführung von nicht-traditionellen PSA in einem medizinischen Umfeld; was tun, wenn der Notfall-Anleitung fehlt, wie es derzeit ist, in vielen Ländern; und, wie nicht-traditionelle Geräte eingeführt werden sollte, in das hospital supply-chain-in einem rationalen, sicheren und kontrollierten Weise“, sagt co-senior Studie Autor Nicole LeBoeuf des Brigham und der Harvard Medical School.
Um diese Anforderung zu erfüllen, Yu, LeBoeuf, und co-senior-Autor der Studie Peter Sorger von der Harvard Medical School verwendet ein Forschung-Protokoll unter der Aufsicht von der Universität ‚ s institutional review board zu testen, die lokal hergestellt Gesichtsschutz als ein investigational-Gerät. Dies erlaubt dem Kliniker zur Teilnahme in einem iterativen design-Prozess, gefolgt von real-world testing in der Notaufnahme. Yu sagt, dieser Ansatz ist einzigartig, weil feedback erhalten wurde parallel, was zu einer schnelleren Implementierung.
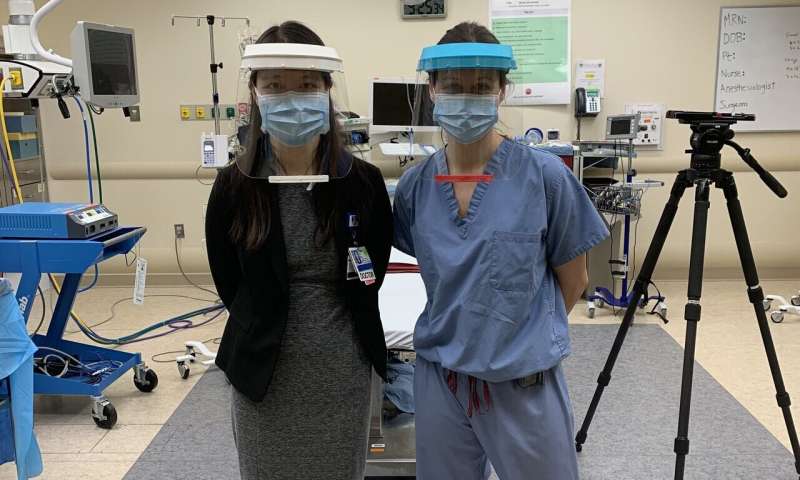
Die Forscher begannen mit der 3-D-gedruckte Prusa RC2-Gesicht-Schild-design entwickelt, in der Tschechischen Republik. Sie verbesserten sich auf dieses design zu gewährleisten, beschränkt sich die aerosol-und splatter-Exposition kommen von vorne und von oben, Widerstand zu beschlagen, und Komfort für all-Tag tragen eine hohe Intensität der klinischen Einstellung. Insgesamt vier wesentliche design-änderungen wurden auf der Grundlage der klinischen feedback, und das daraus resultierende design beinhaltet viele features, die nicht vorhanden sind, sind in Einweg-kommerziellen Gesicht Schilde.
Erstens, die Forscher erhöhten die Breite zu maximieren Gesicht schützen ohne Behinderung hören oder Behinderung eines Benutzers Palette von Bewegung. Zweitens, die Sie verwendet, Haken-und-loop-Klettverschluss zur Anpassung jedes Visier auf einzelne Benutzer. Drittens, Sie reduziert die Dichtheit durch die Platzierung von Ankerpunkten für die Haken-und-loop-Riemen in einer Linie mit der Stirnbänder.
Und viertens, die Forscher Hinzugefügt, ein Visier über dem Stirnband, um zu verhindern, dass Flüssigkeit aus der Eingabe der Oberseite der Gesichtsschutz während der high-risk-Verfahren, in denen ein Arzt erforderlich ist, um nach vorne lehnen. Dies beinhaltet die endotracheale intubation für mechanische Lüftung, eine der riskanteren Verfahren, die durchgeführt werden müssen, auf COVID-19 Patienten. Sie haben auch Hinzugefügt, eine Kunststoff-Lippe an der Unterseite des Visiers, so dass alle Flüssigkeit, die fielen auf diesem Gebiet könnten beibehalten werden, die von der Lippe und würde nicht ausbreiten auf der Vorderseite des Schildes und die Auswirkungen auf einen Benutzer, der die vision.
Unter den 92 Befragten Mitarbeiter der Notaufnahme, die meisten geantwortet, dass die das BWH/PanFab Gesicht Schild war besser in Bezug auf splash-Schutz (96%), Robustheit und Zuverlässigkeit (92%), leichte Bedienbarkeit (78%), Bequemlichkeit (87%). Darüber hinaus 92% geplant weiter zu verwenden, die das BWH/PanFab Gesicht Schild, und 99% antworteten, Sie wäre komfortabel oder sehr komfortabel über dieses Schild in einem klinischen Szenario, in dem Sie hatten keine andere Wahl.
Der gesamte Prozess der Einführung eines nicht-traditionell hergestellte Produkt in ein Krankenhaus supply-chain-in einem sicheren und kontrollierten Art und Weise, dauerte nur drei Wochen. Mit einem design in der hand und institutionelle Unterstützung, andere bereitstellen können, diesen Prozess in zwei Wochen oder weniger, plus zwei bis drei Tage für die klinische Prüfung, wenn die design-änderungen sind notwendig, weil der material-Knappheit. Bisher haben die Forscher hergestellt von rund 3.000 Gesicht-Schilde, die alle weiter genutzt werden können. Derzeit sind Sie die Bewertung verschiedener Verfahren zur Sterilisation und Wiederverwendung von Gesicht Schilde und ähnliche PSA und klinisch testen eine alternative Gesicht-Schild-design verpackt werden kann flach zu erleichtern Transport und Lagerung.
Sorger sagt, dass die Veränderungen in den regulatorischen Leitlinien erforderlich sind, zu erleichtern, die Art der Tests, die Sie verwendet für Ihre Gesicht Schilde. Außerdem, Krankenhaus-Systeme müssen die Mitarbeiter Ihre Krise und response-teams mit Personen, die speziell beauftragt mit der öffentlichkeitsarbeit maker und Herstellung von Gemeinschaften.
